Con este blog se pretende dar a conocer los aspectos teóricos mas importantes sobre los ensayos mas comunes para caracterizar los esteres, ademas de realizar algunos ensayos generales.
INTRODUCCIÓN
Los Esteres son compuestos que se forman por la unión de ácidos con alcoholes, generando agua como subproducto.
Como se ve en el ejemplo, el hidroxilo del ácido se combina con el hidrógeno del radical hidroxilo del alcohol.
Nomenclatura: Se nombran como si fuera una sal, con la terminación “ato” luego del nombre del ácido seguido por el nombre del radical alcohólico con el que reacciona dicho ácido.
Los ésteres se pueden clasificar en dos tipos:
Ésteres inorgánicos: Son los que derivan de un alcohol y de un ácido inorgánico. Por ejemplo:
Ésteres orgánicos: Son los que tienen un alcohol y un ácido orgánico. Como ejemplo basta ver el etanoato de propilo expuesto arriba.
Otro criterio o forma de clasificarlos es según el tipo de ácido orgánico que se uso en su formación. Es decir, si se trata de un ácido alifático o aromático. Aromáticos son los derivados de los anillos bencénicos como se ha explicado anteriormente. Para los alifáticos hacemos alusión nuevamente al etanoato de propilo anteriormente expuesto.
Al proceso de formación de un éster a partir de un ácido y un alcohol se lo denomina esterificación. Pero al proceso inverso, o sea, a la hidrólisis del éster para regenerar nuevamente el ácido y el alcohol se lo nombra saponificación. Este término como veremos es también usado para explicar la obtención de jabones a partir de las grasas. (alicica lamarque, 2008)
Obtención de Ésteres:
Los ésteres se preparan combinando un ácido orgánico con un alcohol. Se utiliza ácido sulfúrico como agente deshidratante. Esto sirve para ir eliminando el agua que se forma y de esta manera hacer que la reacción tienda su equilibrio hacia la derecha, es decir, hacia la formación del éster.
Combinando anhídridos con alcoholes.
Propiedades físicas:
Los que son de bajo peso molecular son líquidos volátiles de olor agradable. Son las responsables de los olores de ciertas frutas.
Los ésteres superiores son sólidos cristalinos, inodoros. Solubles en solventes orgánicos e insolubles en agua. Son menos densos que el agua.
Propiedades Químicas:
Hidrólisis ácida:
Ante el calor, se descomponen regenerando el alcohol y el ácido correspondiente. Se usa un exceso de agua para inclinar esta vez la reacción hacia la derecha. Como se menciono es la inversa de la esterificación.
Hidrólisis en medio alcalino:
En este caso se usan hidróxidos fuertes para atacar al éster, y de esta manera regenerar el alcohol. Y se forma la sal del ácido orgánico.(fabio restrepo,2003)
Usos de los ésteres:
Hidrólisis ácida de ésteres
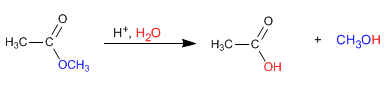
Los ésteres se hidrolizan en medios acuosos, bajo catálisis ácida o básica, para rendir ácidos carboxílicos y alcoholes.
Hidrólisis básica de ésteres. Saponificación
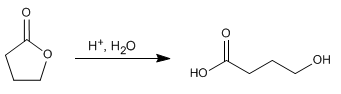
Hidrólisis de Lactonas
Transesterificación ácida de ésteres
Transesterificación en medio básico
Reacción de ésteres con organometálicos
Reducción de ésteres a alcoholes
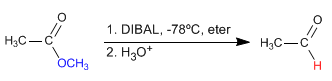
Reducción de ésteres a aldehídos: DIBAL
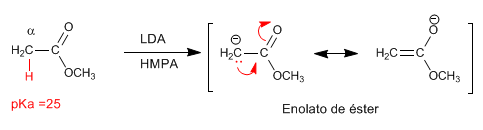
Enolatos de éster
Condensación de Claisen
Nomenclatura
* Por otro lado, son usados en la elaboración de sabores y olores, y por ello, son principalmente utilizados en las industrias alimenticias y cosméticas para la fabricación de chicles, jabones y perfumes, entre otros. Asimismo, también se usan en las industrias resineras y petroquímicas para la elaboración de resinas sintéticas, lacas, pinturas y plásticos. * Los esteres son excelentes disolventes de compuestos polares debido a su enlace covalente entre el oxígeno y el carbono, y por ello son solubles en ellos.
Debilidades
* La Benecetidina C22H29NO3 (ester etílico del acido 1-(2-benziloxietil)-4-fenilpiperidina-4-carboxilico) y a sus sales con Bromo y Cloro, tienen efectos parecidos a los de la morfina, es decir, son tóxicas, pueden estimular un fallo renal si se acumulan y son altamente adictivas.
* Asimismo la cocaína (Ester metílico de Benzoilcgnonina), es una estimulante que funciona mediante la modulación de la dopamina, un neurotransmisor que puedeencontrarse en ciertas zonas del cerebro. Su uso desenfrenado produce adicción, desórdenes mentales e incluso la muerte.(douglas skoog,1996)
Usos de los ésteres:
Hidrólisis ácida de ésteres
Los ésteres se hidrolizan en medios acuosos, bajo catálisis ácida o básica, para rendir ácidos carboxílicos y alcoholes.
Hidrólisis básica de ésteres. Saponificación
Hidrólisis de Lactonas
Transesterificación ácida de ésteres
Transesterificación en medio básico
Reacción de ésteres con organometálicos
Reducción de ésteres a alcoholes
Reducción de ésteres a aldehídos: DIBAL
Enolatos de éster
Condensación de Claisen
Nomenclatura
Metanoato de metilo
(Formiato de metilo) |
Etanoato de etilo
(Acetato de etilo) | ||
Benzoato de etilo
|
Propanoato de fenilo
| ||
3-butenoato de metilo
|
Isopentiloato de isopropilo
|
 |
| Reacción general de obtención de Ésteres |
- Pueden formar enlaces de hidrógeno
- Son más solubles que los hidrocarburos de los que derivan pero menos que los alcoholes correspondientes
- Tienen un olor característico que los hace ser empleados como fragancias artificiales
* Por otro lado, son usados en la elaboración de sabores y olores, y por ello, son principalmente utilizados en las industrias alimenticias y cosméticas para la fabricación de chicles, jabones y perfumes, entre otros. Asimismo, también se usan en las industrias resineras y petroquímicas para la elaboración de resinas sintéticas, lacas, pinturas y plásticos. * Los esteres son excelentes disolventes de compuestos polares debido a su enlace covalente entre el oxígeno y el carbono, y por ello son solubles en ellos.
Debilidades
* La Benecetidina C22H29NO3 (ester etílico del acido 1-(2-benziloxietil)-4-fenilpiperidina-4-carboxilico) y a sus sales con Bromo y Cloro, tienen efectos parecidos a los de la morfina, es decir, son tóxicas, pueden estimular un fallo renal si se acumulan y son altamente adictivas.
* Asimismo la cocaína (Ester metílico de Benzoilcgnonina), es una estimulante que funciona mediante la modulación de la dopamina, un neurotransmisor que puedeencontrarse en ciertas zonas del cerebro. Su uso desenfrenado produce adicción, desórdenes mentales e incluso la muerte.(douglas skoog,1996)
La mejor aplicación es utilizarlo en esencias para dulces y bebidas ya que se hallan de forma natural en las frutas. Otros para preparar perfumes.
Otros como antisépticos, como el cloruro de etilo.
Otros como antisépticos, como el cloruro de etilo.

En medios ácidos la hidrólisis de ésteres se puede escribir mediante la siguiente ecuación química:
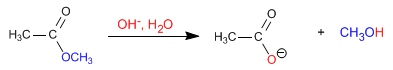
Hidrólisis ácida de la g-butirolactona
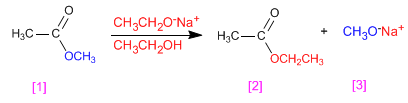
El etanoato de metilo [1] reacciona con etóxido de sodio para formar etanoato de etilo [2] y metóxido de sodio [3]
TRANSESTERIFICACIÓN EN MEDIO BÁSICO
TRANSESTERIFICACIÓN EN MEDIO BÁSICO
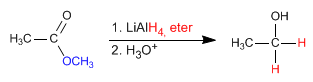
El reductor aporta iones hidruro al carbono carbonilo transformándolo en alcohol
REDUCCIÓN DE ÉSTERES A ALCOHOLES
REDUCCIÓN DE ÉSTERES A ALCOHOLES
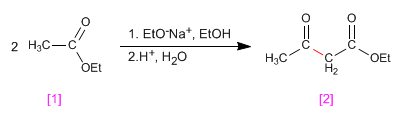
El etanoato de etilo [1] condensa en presencia de un equivalente de etóxido en etanol seguido de etapa ácida, para formar 3-oxobutanoato de etilo [2] (3-cetoéster)
Los ésteres reciben nombres como si fueran sales inorgánicas.
 Los ésteres son compuestos orgánicos constituidos a base de un grupo acilo (derivado de un oxoácido) R-CO- y un grupo alquilo -R, unidos por un átomo de oxígeno O.
Los ésteres son compuestos orgánicos constituidos a base de un grupo acilo (derivado de un oxoácido) R-CO- y un grupo alquilo -R, unidos por un átomo de oxígeno O.
La fórmula general, por lo tanto, es: R-CO O-R
R-CO es el grupo acilo y -R es el grupo alquilo (metil, etil, propil, etc.)
La fórmula general, por lo tanto, es: R-CO O-R
R-CO es el grupo acilo y -R es el grupo alquilo (metil, etil, propil, etc.)
Obtención de los Ésteres:
Los Ésteres se obtienen de la reacción de un ácido carboxílico con un alcohol:
Los Ésteres se obtienen de la reacción de un ácido carboxílico con un alcohol:
Propiedades de los Ésteres:
Grupos Funcionales:
Además, también son importantes en la medicina, ya que son utilizados para combatir el asma bronquial y las convulsiones epilépticas. También se utiliza como antiespasmódico, vasodilatador, analgésico, antiinflamatorio, antirreumático, anestésico local y para la prevención y tratamiento de infartos.
* Por otro lado, los esteres pueden causar daños severos tanto en el medio ambiente como en los seres humanos. Una mezcla de esteres adicionado al Roundup (glifosato) y al Cosmoflux, que es altamente venenoso, es aplicada para fumigar cultivos ilegales. Este compuesto provoca daños en cualquier cuerpo con la que entra en contacto causando daños en la vista, fallecimiento de animales y también en los humanos, si son exhibidos en una alta cantidad a la fumigación. (flora acuñas, 2006)
ANÁLISIS FUNCIONAL DE
ESTERES
Se realizaron los ensayos más comunes para caracterizar los
ésteres, se desarrolló la práctica de laboratorio de química orgánica con el
propósito de conocer su comportamiento y naturaleza familiarizarnos con los ensayos más utilizados
de este tipos de compuestos
ENSAYOS
GENERALES
OBJETIVOS PLANTEADOS
GENERAL
Reconocer e identificar los esteres llevando a cabo los
ensayos cualitativos de solubilidad y el ensayo general de hidroxamato férrico utilizando
el éster acetato de etilo para observar las reacciones en las que interviene el
grupo funcional R-COO-R.
ESPECÍFICOS
Describir las reacciones de solubilidad explicando por qué
dieron positivas o negativas
Mencionar otros ensayos que involucran los esteres como el
de hidrolisis básica describiendo su procedimiento y los resultados que se
esperarían
Analizar las reacciones del ensayo general de hidroxamato
férrico y realizar las respectivas conclusiones.
MATERIALES Y
REACTIVOS
Una gradilla para tubos de ensayo
Ocho tubos de ensayo
Pipetas de Pasteur
Se utilizaron los siguientes reactivos
HCl al 10%, NaOH al 10%, NaHCO3 al 10% y H2SO4 concentrado
FeCl3 al 5% y etanol del 95%
ENSAYOS DE
SOLUBILIDAD
Se realizaron los respectivos ensayos para observar si se
presentaba solubilidad agregándole 0.2 ml de acetato de etilo a los respectivos
solventes que se habían colocado previamente en los tubos de ensayo con un
volumen de 1.0 ml. Se obtuvieron los siguientes resultados.
HCL 10%
Se forman dos fases siendo el ácido el más denso (pon cada enunciado encima de las fotos
correspondientes).
Las hidrólisis de ésteres ocurren a través de un mecanismo típico de sustitución nucleofílica en el grupo acilo en el que el ion hidróxido es el nucleófilo que se adiciona al grupo carbonilo del éster para dar un intermediario tetraédrico. La pérdida del ion alcóxido da un ácido carboxílico, el cual se desprotona para generar el ion carboxilato. La adición de HCl acuoso en un paso separado después de que la saponificación se completa protona el ion carboxilato y da el ácido carboxílico. (alicia lamarque,2008)
NaHCO3 5%
La solubilidad da negativa se forma una fase pequeña.
NaOH 10%
Da negativa la solubilidad formándose dos fases fácilmente
observables.
H2SO4 conc.
Se solubiliza. también se calienta la solución
ETER
Solubilidad positiva.
Inicialmente da solubilidad positiva sin embargo se forman
dos fases a los pocos minutos.
Los esteres son capaces de aceptar enlaces de hidrogeno de otros líquidos con enlaces de hidrogeno, esto permite que los esteres de baja masa molecular sean solubles en agua y los de mayor masa molecular insolubles. Los esteres son solubles en la mayoría de los solventes orgánicos, su solubilidad la determina la longitud dela cadena hidrocarbonada.
SOLVENTE SOLUBILIDAD
HCL NEGATIVO
NaHCO3 NEGATIVO
NAOH NEGATIVO
H2SO4 POSITIVO
ETER POSITIVO
AGUA NEGATIVO
ENSAYO GENERAL
Ensayo de hidroxamato
férrico
Se colocó una gota de acetato de etilo en un tubo de ensayo
y se procedió a adicionarle 1 ml de etanol del 95% luego de disuelta la muestra
se continuo adicionándole 1 ml de HCl 1 N y dos gotas de cloruro férrico (FeCl3)
al 5% dando una coloración amarilla, indicando que era posible proceder con el
ensayo de hidrozamáto férrico
La segunda parte no fue posible realizarla debido a que no
se encontraba el compuesto de clorhidrato de hidroxilamina.
Sin embargo se pretendía disolver tres gotas de nuestra
sustancia problema en una mezcla de 1 ml de hidroxilamina (HCl-H2N-OH) 0.5 N y
0.2 mL de hidróxido de sodio 6 N
Se calentaría la mezcla a ebullición de 2 a 4 minutos y se
enfriaría posteriormente a temperatura
ambiente para adicionarle 2 mL de HCl 1N
y se le agregaría finalmente FeCl3 hasta que la mezcla adquiriera y mantuviera
una tonalidad vino tinto
La primera etapa de
la reacción es la conversión del éster en un ácido hidroxamico. En el siguiente
paso este reacciona con cloruro férrico produciendo un hidroxamato de intenso
color rojo-violeta
Este ensayo es de
gran utilidad para reconocer ésteres debido a la coloración característica que
estos adquieren
Hidrólisis básica
Este ensayo no fue llevado a cabo pero se describen los
pasos y las reacciones que lo caracterizan así como la utilidad de su
realización
Inicialmente se coloca 1g
de nuestra sustancia problema en un balón de fondo redondo y 10 mL de
NaOH al 25% posteriormente se introducirían las perlas de ebullición y se
acoplaría el condensador para dejar media hora la mezcla en reflujo. Después de
hecho lo anterior habría que observar si se ha disuelto el éster observando si
persiste la capa oleosa de este o si se percibe su olor, de ser así deberá
continuarse con el procedimiento mencionado un par de horas y volver a
verificar si se ha disuelto el éster, de lo contrario se buscaría concluir si
es o no un éster.
BIBLIOGRAFIA
Griffin, R. W. (1981). Química orgánica moderna.
reverté. Griffin, R. W. (1981). Química
orgánica moderna. reverté.
Gutsche, C. D. (1978). Fundamentos de química orgánica.
Reverte.
Whitten, K. W., Gailey, K. D., Davis, R. E., Ortega, M. T. A., &
Muradás, R. M. G. (1992). Química general. Madrid: McGraw-Hill.
Alicica Lamarque(2008) .Hola quimica tomo 2Flora Acuñas (2006) Química orgánica
AUTORES
MELANI RAMIREZ
ULISES NIÑO


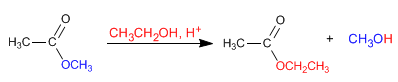
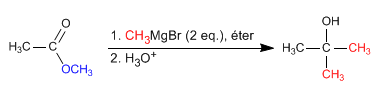








No hay comentarios:
Publicar un comentario